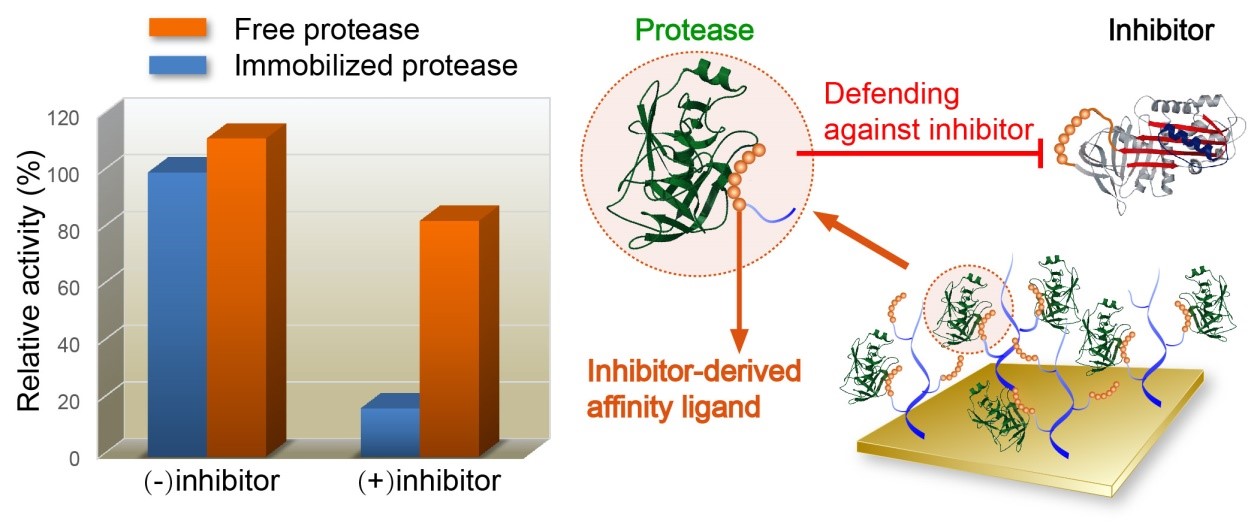
Surface immobilization of protease through an inhibitor-derived affinity ligand: a bioactive surface with defensive properties against inhibitor
Chemical Communications,
2015,
51,
14263-14266.
文章链接:http://dx.doi.org/10.1039/C5CC05652G
唐增超同学在Chemical Communications发表研究论文
发布日期:2015-08-15